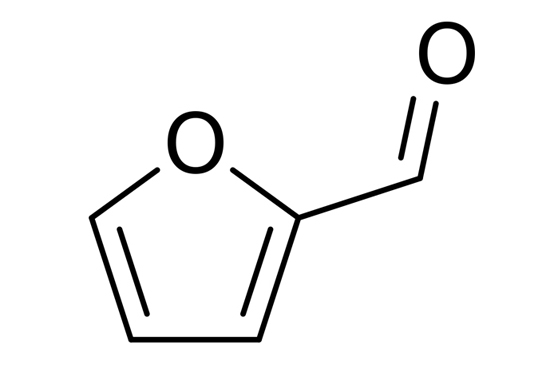
فورفورال چیست ؟
فورفورال ( Furfural) یک ترکیب شیمیایی است که در ساختار خود دارای یک حلقه با 4 اتم کربن و یک اتم کسیژن است با شناسه پابکم ۷۳۶۲ است.
در فرم خالص فورفورال مایعی بی رنگ و روغنی است که دارای بوی بادام می باشد و در تماس با هوا به سرعت زرد می شود.
فورفورال نخستین بار توسط دانشمند آلمانی جان ولفانگ دوبرینر (Johann Wolfgang D'bereiner) بدست آمد. او فورفورال را از مجصول جانبی سنتز اسید فرمیک بدست آورد.
در سال 1840 دانشمند اسکاتلندی جان استنهوز (John Stenhouse) ماده مشابهی را کشف کرد که از تقطیر، جو دو سر، سبوس، خاک اره و ذرت با اسید سولفوریک بدست می آمد.


.jpg)